Viviane Cuendet, enseignante, est venue présenter devant le Conseil Scientifique Indépendant (CSI) les statistiques suisses qui montrent une augmentation massive de diverses maladies et une forte baisse de la natalité de 2020 à 2023. Les jeunes, les enfants et les femmes semblent les plus impactés par ce phénomène que tout ramène aux injections Covid. Plusieurs idées reçues sur la pandémie sont également bousculées.
Les milieux critiques des mesures officielles contre le Covid s’étonnent que les autorités sanitaires, ainsi que les milieux politiques, scientifiques et médiatiques restent silencieux face à des chiffres aussi spectaculaires que difficiles à nier.
Tous les graphiques et plus d’informations se trouvent dans le document pdf en fin d’article
Le mythe d’une pandémie mortelle
Viviane Cuendet a passé les dernières deux années à traduire bénévolement en français les publications et présentations de Real Data Hero, un canal d’information allemand sur les données statistiques liées au Covid, ainsi que d’autres vidéos qu’elle diffuse sur son canal.
« Comme Pierre Chaillot l’a montré pour la France, la réalité de la mortalité Covid en Suisse est fort différente de l’image dramatique assénée par les politiciens et les médias. » Viviane Cuendet
Sa démonstration débute par un tableau (voir ci-dessous) montrant les taux de mortalité classés et ajustés en fonction de l’évolution démographique de 2010 à 2022 par tranche d’âge de 5 ans. Pour chaque tranche d’âge (ligne), il y a une valeur rouge, qui représente l’année la plus mortelle, et une valeur verte, qui représente la meilleure année.
Un constat s’impose : l’année 2020 était une année normale, classée 5e sur ces treize années, qui a suivi une année 2019 où la mortalité était particulièrement basse. Il serait impossible de déduire à partir de ce tableau qu’une quelconque épidémie mortelle ait eu lieu en 2020.
Où sont donc les milliers de morts Covid annoncés en Suisse, qui ont été présentés comme des morts supplémentaires dûs au virus ? Ce tableau démontre qu’ils ont été absorbés dans la mortalité usuelle et que sont morts avec un label Covid en grande majorité des personnes en fin de vie ou déjà gravement malades.
Il faut rappeler qu’il suffisait d’avoir été testé positif au SARS-CoV-2 pour alimenter le compteur des décès Covid, peu importe les autres maladies, peu importe si la personne était symptomatique. Cette manière de faire avait pourtant déjà fait débat, notamment suite à une intervention télévisée du Conseiller fédéral suisse Ignazio Cassis.
« Visuellement, s’il avait fallu déclarer une urgence sanitaire, cela aurait dû être en 2010. » Viviane Cuendet.

Nombre record d’effets indésirables en 2021
50.4 fois plus d’effets indésirables suite à une vaccination Covid ont été annoncés en 2021 que la moyenne des dix dernières années en Suisse, tous vaccins confondus.
Comment les autorités et les grands médias ont-ils pu passer à côté d’une information aussi importante sur le déroulement de cette pandémie qui occupait la majorité de l’espace médiatique ? À l’heure où ces chiffres étaient connus, les autorités continuaient d’affirmer que le vaccin Covid était « sûr ».
Un biais méconnu est à mentionner ici : seulement entre 1 et 10% des effets indésirables des vaccins sont déclarés. On peut donc multiplier le nombre d’effets indésirables remontés par un chiffre entre 10 et 100 pour obtenir le nombre réel.
Cette sous-annonce est due à plusieurs facteurs : le personnel médical n’est pas rémunéré pour cette tâche qui demande un grand travail administratif et la grande résistance psychologique du corps médical à admettre un potentiel dégât d’une mesure qu’ils ont prônée.
Même si le lien de cause à effet ne doit pas être établi pour annoncer un effet indésirable et que le déclarer est une obligation légale, notre rédaction connaît des cas de médecins qui refusent de le faire, peut-être par peur d’une quelconque responsabilité.
Ceci étant, les injections Covid semblent avoir déclenché un nombre inédit de troubles de la santé, dont certains graves qui changent durablement la vie des personnes concernées.

Surmortalité chez les 20-29 ans
La seule tranche d’âge pour laquelle la mortalité a été record sur les treize dernières années est celle des 25 à 29 ans, en 2021.
Viviane Cuendet a retrouvé les statistiques précises de l’écart entre la mortalité attendue et la mortalité effective. Ces chiffres montrent qu’il y a une corrélation entre l’augmentation du nombre de décès et le nombre de doses vaccinales administrées (voir le graphique ci-dessous).
Comme on sait également que la santé psychologique de la population s’est extrêmement dégradée durant cette période qui a été marquée par la discrimination d’un tiers des citoyens non vaccinés contre le Covid, on ne peut pas exclure que ce soit le nombre de suicides qui se soit cumulé avec les décès post-vaccinaux pour expliquer cette situation hors normes.

Baisse persistante de la natalité
Pour 2022, la natalité en Suisse est inférieure de 8,5% par rapport à 2020 et de 6% par rapport à la moyenne de 2018 à 2021 alors que le nombre de femmes en âge de procréer est resté stable.
Nous avions déjà traité à plusieurs reprises ce sujet dans nos colonnes, le graphique le plus marquant étant certainement celui reproduit ci-dessous et qui montre qu’avant le début des campagnes de vaccination, il n’y avait pas de fluctuation aussi marquée des naissances, également que cette fluctuation est fortement corrélée au nombre de doses administrées dans les tranches d’âge concernées.
Ceci permet d’éliminer tout facteur psychologique comme explication de cette baisse – on aurait dans ce cas dû observer non pas une baisse mais une augmentation des naissances, vu que les vaccins Covid étaient présentés comme la solution à la crise.
Les chiffres de la natalité disponibles pour 2023 montrent que cette tendance persiste.

Pour rappel, la vaccination des femmes enceintes reste prônée, malgré la controverse des données manipulées que nous avions décrite dans un autre article. Nous avions contacté à l’époque les autorités sanitaires du Canton de Genève qui n’ont à ce jour toujours pas changé leurs directives.
Considérer les femmes enceintes comme des personnes à risque par rapport au Covid s’avère de plus démenti par les chiffres officiels. En effet, lors de l’année d’émergence du Covid (2020), le taux de mortinaissances était inférieur (0.37%) à celui de l’année du Covid (2021, 0,44%). Les mortinaissances spécifiques aux grossesses in vitro ont augmenté de 65%, probablement car la vaccination Covid devait être une condition sine-qua-non à un processus in vitro (voir graphique ci-dessous, l’année 2020 est représentée avec un grand coronavirus, l’année 2021 avec une seringue pour les vaccinations et un petit coronavirus, car la population était pratiquement complètement immunisée et le variant était moins dangereux).
Pourquoi les autorités ignorent de tels signaux d’alarme ? Certaines voix critiques estiment que c’est parce que ce sont ces mêmes autorités qui ont prôné la vaccination et qu’elles n’agissent actuellement plus dans le sens de l’intérêt général, pour ne pas devoir s’expliquer ou assumer. Il manque dans ce système une autorité de surveillance indépendante.

Occupation des lits hospitaliers
Avant d’entrer dans le thème plus grave des maladies, Viviane Cuendet se penche sur les statistiques d’occupation des lits hospitaliers de 2020 à mai 2023. La première chose qui saute aux yeux est que la situation actuelle en 2023 est bien pire (en terme de lits disponibles et de soins hors Covid) que lors de la pandémie. Pour rappel encore, il suffit d’être testé positif au SARS-CoV-2 pour être compté comme une hospitalisation Covid, même si l’on est hospitalisé pour une autre raison.

Dégâts vaccinaux et hospitalisations sous la loupe
L’enseignante a recherché dans environ 300’000 lignes de données statistiques pour comparer l’évolution de certaines causes d’hospitalisation en Suisse sur six années (2016 à 2021), grâce aux codes diagnostics. Elle s’est concentrée sur les codes qui sont officiellement admis comme étant des effets indésirables des injections Covid. Cette approche représente exactement ce qui se passe dans la réalité, est beaucoup plus fiable que les modélisations qui sont souvent présentées pour affirmer l’innocuité des vaccins Covid.
Une bonne partie des graphiques ci-dessous concernent la tranche d’âge des 15 à 39 ans. En Suisse, 50% des 10 à 19 ans ont reçu au moins une dose, 73% chez les 20 à 29 ans et 74% chez les 30 à 39 ans. Cette tranche d’âge a augmenté de 0,17% de 2020 à 2021.
Qui a connu le plus d’effets indésirables ?
Les données officielles à disposition permettent de voir que la tranche d’âge des 18 à 44 ans est celle qui a supporté le plus d’effets indésirables post-vaccinaux en Suisse. À l’heure d’écrire cet article, pas moins de 16 855 effets indésirables ont été annoncés, soit environ 1 effet pour 1000 doses. 38% d’entre eux sont des effets indésirables graves.
Viviane Cuendet rappelle que cette tranche d’âge n’aurait pas dû être soumise à une mesure sanitaire qui ne lui bénéficiait pas, alors que l’âge moyen des décès Covid se situait autour de 84 ans. Les chiffres montrent également que les femmes représentent 61,5% du nombre total recensé.

Myocardites
Les autorités sanitaires suisses continuent en 2023 d’affirmer sur leur site internet que les « myocardites et péricardites sont plus rares après l’injection d’un vaccin à ARNm qu’après une infection ».
Cette affirmation semble absolument contraire aux chiffres officiels, qui montrent une augmentation de 99% d’hospitalisations dues à des myocardites non pas l’année du virus seul, mais bel et bien l’année de la vaccination Covid, en 2021, pour les 15 à 39 ans.

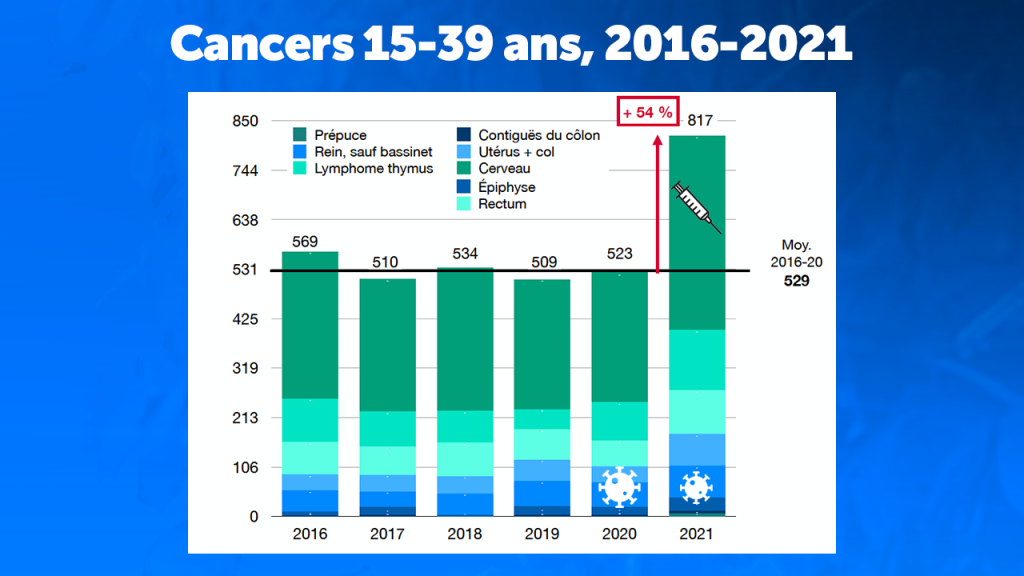
Cancers
Le nombre d’hospitalisations pour des cancers a toujours été très stable de 2016 à 2020, comme le montre le graphique ci-dessous pour les 15 à 39 ans. Seule l’année 2021 montre une anomalie avec des augmentations allant de 26 à 240% suivant les types de cancers (pour les détails, voir le document pdf en fin d’article).
L’augmentation cumulée pour les cancers en 2021 se monte à 54% par rapport à la moyenne de 2016 à 2020.
Flambée de tumeurs malignes chez les 0-14 ans
Viviane Cuendet a également recherché les taux d’hospitalisations pour des tumeurs malignes chez les 0 à 14 ans. Les chiffres qu’elle a trouvés semblent choquants.
Le taux de vaccination de cette tranche d’âge est difficile à déterminer car les chiffres officiels disponibles concernent les 0 à 9 ans qui sont vaccinés à hauteur de 3,71% et ceux de 10 à 19 ans qui sont vaccinés à hauteur de 50,43%. Il est probable que la plus grande partie des vaccinés de cette tranche soient les 18 à 19 ans et que les 0 à 14 ans ne soient vaccinés qu’à hauteur d’environ 10% au maximum.
Une augmentation de 249% s’est produite l’année des vaccinations Covid. L’impact des vaccins Covid à ARN messager semble beaucoup plus fort chez les enfants que chez les adultes, c’est d’ailleurs ce qui avait poussé certains pays à cesser de les recommander aux moins de 40 ans.
Et ceci alors qu’une petite fraction de cette tranche d’âge a été effectivement vaccinée. Probablement ceux qui étaient considérés à risque. D’après ces chiffres, la tendance générale qui se dessine est que les vaccins Covid n’ont pas amélioré leur santé globale, au contraire, et une enquête officielle semble plus que jamais nécessaire pour le déterminer, vu que ces vaccins sont toujours disponibles pour cette classe d’âge.

Atteintes du système nerveux
Les atteintes du système nerveux sont le deuxième effet indésirable le plus important après les réactions locales. Une augmentation de 25% est observée pour ces troubles qui sont en général lourds de conséquences.

Maladies auto-immunes
Viviane Cuendet rappelle que Swissmedic, l’organe qui autorise la mise sur le marché de médicaments en Suisse, s’était inquiété en janvier 2021 dans une lettre adressée à Moderna que « la large diffusion de l’ARNm codant pour la protéine spike du SARS-CoV-2 peut également se produire chez l’homme et ouvrir la voie à divers troubles auto-immuns spécifiques à des organes. Ces troubles présentent généralement une longue phase pré-symptomatique. »
Le grand public n’a pas été informé de ce risque et les effets à long-terme ont été niés alors que dans les coulisses, Swissmedic connaissait ce risque.
L’organe de contrôle des médicaments s’était alors contenté de la réponse de Moderna qui lui avait dit que que l’entreprise évaluait « la faisabilité des propositions parrainées par des investigateurs » et qu’elle fournirait « des informations actualisées à Swissmedic dès qu’elles seront disponibles. »
Une chose est certaine, ces informations n’ont jamais été rendues publiques, on ne sait même pas si Swissmedic les a reçues.
Au total, comme le montre le graphique ci-dessous, une augmentation de 40% est observé pour ces maladies. L’enseignante rappelle que « les maladies listées ne sont pas forcément plus bénignes qu’un Covid, que le vaccin ne permet d’ailleurs pas d’éviter ».

Concernant les 0 à 14 ans, Viviane Cuendet a trouvé une augmentation anormale (+477%) pour la neuromyélite optique, une maladie auto-immune rare, qui fait partie des maladies inflammatoire, démyélinisante du système nerveux central, une maladie qui débute en moyenne à 40 ans. Sans traitement, la perte de la vue ou une paralysie peuvent être définitives.

Hémorragie cérébrale
Une augmentation de 36% est observée en 2021 pour les hémorragies cérébrales, qui ne sont certainement pas dues à des retards de diagnostics.

Grossesse et accouchement
Les codes d’hospitalisations liés à une grossesse ou à un accouchement montrent une dramatique augmentation de 25% en 2021.

Ce sont des hémorragies diverses, des troubles de la coagulation, des infections du sac amniotique et une augmentation de 110% pour les soins au cours de la grossesse pour avortements à répétition.

Divers troubles
11 codes divers représentant des maladies qui ne sont pas bénignes, sélectionnées par Viviane Cuendet, montrent une augmentation de 64% pour les 15 à 39 ans.

L’hypertension pulmonaire (+176%) est à elle seule très inquiétante vu que la mortalité est de 20 à 30% à 3 et 5 ans pour des patients traités, selon le registre français des maladies.

Pour les 0 à 14 ans, on peut aussi relever l’augmentation anormale du nombre de jaunisses (sans les nouveaux-nés) de 900%.

Très inquiétant aussi pour les 0 à 14 ans, le nombre d’hospitalisations pour arrêt cardiaque, embolie pulmonaire ou AVC et infarctus cérébral, qui, après une légère baisse de 2017 à 2020, a augmenté de 125% l’année des vaccinations Covid, dans l’indifférence générale.

Conclusion
Viviane Cuendet affirme en conclusion que même si l’on ne connaît pas le statut vaccinal des personnes touchées, de tels écarts statistiques en 2021 devraient tout de même déclencher des enquêtes de la part des autorités.
« Si corrélation n’est pas causalité, quels facteurs sont responsables de ces augmentations juste en 2021? » Viviane Cuendet
Si les injections Covid sont bien la cause de ces milliers d’hospitalisations supplémentaires – visibles dans les statistiques d’occupation des lits hospitaliers – les pourcentages présentés par l’enseignante seraient donc pires si on ne considérait que la partie de la population vaccinée.
L’enseignante a envoyé ses recherches aux 241 parlementaires au niveau national en Suisse. Lors de de sa présentation au CSI trois semaines plus tard, elle n’avait toujours reçu aucune réponse.
La journaliste Amèle Debey a interpellé l’Office Fédéral de la Statistique (OFS) qui lui a répondu qu’ils n’étaient responsables que de la fourniture de ces chiffres et pas de leur interprétation.
L’Office fédéral de la santé publique (OFSP) a quant a lui a botté en touche en répondant qu’ils n’avaient pas de chiffres concrets qui pourrait confirmer ceux apportés par cette analyse, qu’ils ne contestaient pas ces chiffres, mais n’avaient pas l’indication pour les interpréter.
Pour rappel, l’OFSP dépend directement du Conseiller fédéral en charge de la santé, Alain Berset, qui a tout fait pour que la solution de sortie de la crise soit le vaccin Covid. Ce ministre qui a affirmé haut et fort que les vaccins étaient « sûrs et efficaces » malgré des chiffres qui semblent montrer une toute autre réalité.
Le rôle des médias de service public ne serait-il pas d’informer la population sur ces chiffres pour qu’un débat ouvert puisse enfin avoir lieu ?
Références